Chlordifluormethan
V dnešním světě je Chlordifluormethan téma, které si získalo velkou relevanci a pozornost v různých oblastech, ať už v osobní, sociální, ekonomické nebo politické sféře. Jeho dopad vyvolal různé názory a postoje, což z něj činí téma neustálých diskusí. Kromě toho Chlordifluormethan vzbudil zájem odborníků a specialistů, kteří věnovali čas a úsilí jejímu studiu a analýze. V tomto článku prozkoumáme různé aspekty, které Chlordifluormethan představuje, abychom pochopili jeho důležitost a relevanci dnes.
| chlordifluormethan | |
|---|---|
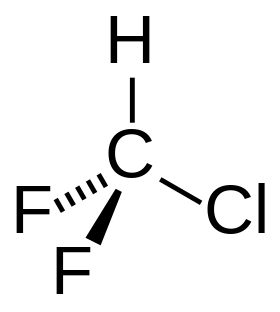 Chlordifluormethan | |
| Obecné | |
| Sumární vzorec | CHClF₂ |
| Identifikace | |
| Registrační číslo CAS | 75-45-6 |
| Vlastnosti | |
| Molární hmotnost | 85,973 Da |
| Bezpečnost | |
| [1] Varování[1] | |
Některá data mohou pocházet z datové položky. | |
Chlordifluormethan (též difluormonochlormethan) je halogenderivát methanu. Tento bezbarvý plyn patří mezi tzv. freony, jako chladivo je znám pod označeními HCFC-22 a R-22. Dříve se používal jako hnací plyn ve sprejích a jako chladivo v klimatizačních zařízeních. V těchto oblastech se již nepoužívá, protože může poškozovat ozónovou vrstvu a je též silným skleníkovým plynem. Nadále se však využívá jako víceúčelový meziprodukt v průmyslové organofluorové chemii, například jako prekurzor tetrafluorethylenu.
Výroba a použití
Chlordifluormethan se připravuje z chloroformu:
Hlavní oblastí použití je výroba tetrafluorethylenu. Tato konverze se skládá z pyrolýzy, při které vzniká difluorkarben, jenž dimerizuje:[2]
- 2 CHClF2 → C2F4 + 2 HCl
Výsledná sloučenina za přítomnosti silné zásady poskytuje zpět difluorkarben, což se v laboratoři využívá k získání tohoto reaktivního meziproduktu.
Pyrolýzou chlordifluormethanu za přítomnosti chlorfluormethanu vzniká hexafluorbenzen.
Reference
V tomto článku byl použit překlad textu z článku Chlorodifluoromethane na anglické Wikipedii.
- ↑ a b Chlorodifluoromethane. pubchem.ncbi.nlm.nih.gov . PubChem . Dostupné online. (anglicky)
- ↑ Günter Siegemund, Werner Schwertfeger, Andrew Feiring, Bruce Smart, Fred Behr, Herward Vogel, Blaine McKusick "Fluorine Compounds, Organic" Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a11_349
Externí odkazy
 Obrázky, zvuky či videa k tématu chlordifluormethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlordifluormethan na Wikimedia Commons


